Используются как
стабилизаторы полимерных материалов
и масел и как полупродукты синтеза фосфорорганических соединений.
Лит.см. при ст.
Фосфаты.
гликолиза
– в реакции, следующей за фосфоролизом гликогена: глюкозо-1-фосфат + глюкозо-1,6-дифосфат фосфоглюкомутаза Ы глюкозо-1,6-дифосфат + глюкозо-6-фосфат
.
Фосфат в этой реакции переносится из положения 1 в одной молекуле глюкозы в положение 6 др. молекулы; при этом глюкозо-1,6-дифосфат является коферментом реакции, требующей присутствия ионов Mg
2 +и протекающей следующим образом: фосфорилированная форма Ф. передаёт фосфат в положение 6 глюкозо-1-фосфата с образованием глюкозо-1,6-дифосфата. Оказавшаяся дефосфорилированной Ф. принимает на себя фосфатную группу, стоящую при первом углеродном атоме глюкозо-1,6-дифосфата. Так образуется глюкозо-6-фосфат, а фермент переходит вновь в фосфорилированную форму. Глюкозо-1,6-дифосфат может образоваться также путём киназной реакции: глюкозо-1-фосфат + АТФ (глюкозо-1,6-дифосфат + АДФ.
Ф. широко распространена в растительных, животных и микробных клетках; локализована в цитоплазме. Получена из различных источников в высокоочищенном виде и представляет собой белок с молекулярной массой 60 000 – 112 000. В клетках одного организма Ф. может присутствовать в виде различных, но обладающих близкой активностью белков –
изоферментов.Характерные наборы изоферментов Ф. обнаружены в эритроцитах, печени, почках, мышцах и плаценте человека. Ф. содержит необходимый для каталитической активности остаток
серина.
В. В. Зуевский.
макроэргическое соединение
, важный промежуточный продукт обмена веществ животных, растений и микроорганизмов. Образуется в процессе
гликолиза
из
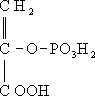
2-фосфоглицериновой кислоты в результате отщепления молекулы воды от последней под действием фермента енолазы, а также из щавелево-уксусной кислоты при её декарбоксилировании, сопровождающемся переносом фосфорильной группы (-H
2PO
3) от нуклеозидтрифосфатов к образующейся
пировиноградной кислоте.В водных растворах Ф. к. легко гидролизуется с образованием фосфорной и пировиноградной кислот. Ф. к. участвует в биосинтезе аденозинтрифосфорной кислоты (АТФ), которая образуется при переносе фосфорильной группы от Ф. к. к аденозиндифосфорной кислоте в результате реакции, катализируемой ферментом пируваткиназой. В живых клетках Ф. к. присутствует в ионизированной форме, называемой фосфоенолпируватом.
сфингозин
)
,жирные кислоты, альдегиды и азотистые соединения (холин, этаноламин, серин). Важнейшие представители Ф. – глицерофосфатиды [фосфатидилхолин (
лецитин
)
,фосфатидилэтаноламин (устаревшее название –
кефалин
)
,фосфатидилсерин, фосфатидилинозит, кардиолипин] и фосфосфинголипиды – сфингомиелины. Каждый класс Ф. объединяет множество однотипных молекул, содержащих различные жирные кислоты или альдегиды. При этом ненасыщенные жирные кислоты преимущественно находятся при 2-м углеродном атоме молекулы глицерина (формулы см. в ст.
Липиды
)
.
Ф. широко распространены в природе. В качестве основных структурных компонентов они входят в состав клеточных мембран животных, растений и микроорганизмов, определяя их строение и проницаемость, а также активность ряда локализованных в мембранах ферментов. С белками Ф. образуют липопротеиновые комплексы. Различным биологическим мембранам присущ определённый состав Ф. Так, кардиолипин – специфический митохондриальный Ф.; сфингомиелин присутствует в основном в плазматических мембранах. В мембранах микроорганизмов всегда содержится фосфатидилглицерин и редко лецитин (в отличие от клеток животных).
Состав Ф. некоторых органов изменяется при старении и ряде патологических состояний организма (атеросклероз, злокачественные новообразования).
Для разделения и установления строения Ф. используют различные виды хроматографии, химический и ферментативный (с помощью фосфолипаз) гидролиз, физические методы исследования (масс-спектрометрия, ИК-спектрометрия, ядерный магнитный резонанс и др.).
Помимо Ф., известны также фосфонолипиды, в которых атом фосфора связан с азотистым основанием (холином и этаноламином) ковалентной Р-С-связью. Эти соединения обнаружены у ряда моллюсков и бактерий.
Лит.:Ленинджер А., Биохимия, пер. с англ., М., 1974; Form and function of phospholipids, 2 ed., Amst. – L. – N. Y., 1973.
Э. В. Дятловицкая.

 ); плотность 1,828
г/см
3,
t
пл44,1 °С,
t
кип280,5 °C, теплота плавления 2,5
кдж/мольP
4(0,6
ккал/мольP
4), теплота испарения 58,6
кдж/мольР
4(14,0
ккал/мольP
4)
,давление пара при 25 °С 5,7
н/м
2(0,043
мм рт. ст.)
.Коэффициент линейного расширения в интервале температур от 0 до 44 °С равен 12,4Ч10
-4
,теплопроводность 0,56
вт/(
мЧК) [1,1346Ч10
-3
кал/(
смЧ
секЧ°С)] при 25 °С. По электрическим свойствам «белый Ф. близок к диэлектрикам: ширина запрещенной зоны около 2,1
эв,удельное электросопротивление 1,54Ч10
11
омЧ
см,диамагнитен, удельная магнитная восприимчивость – 0,86Ч10
-6. Твёрдость по Бринеллю 6
Мн/м
2(0,6
кгс/мм
2)
.a-форма белого Ф. хорошо растворяется в сероуглероде, хуже – в жидком аммиаке, бензоле, четырёххлористом углероде и др. При – 76,9 °С и давлении 0,1
Мн/м
2(1
кгс/см
2) a-форма переходит в низкотемпературную b-форму (плотность 1,88
г/см
3)
.С повышением давления до 1200
Мн/м
2(12 тыс.
кгс/см
2) переход происходит при 64,5 °С. b-форма – кристаллы с двойным лучепреломлением, их структура окончательно не установлена. Белый Ф. ядовит: на воздухе при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой (растворимость в воде при 25 °С 3,3Ч10
-4%)
.Нагреванием белого Ф. без доступа воздуха при 250–300 °С в течение нескольких часов получают красный Ф. Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а также примесями (иод, натрий, селен). Обычный товарный красный Ф. практически полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При длительном нагревании, необратимо может переходить в одну из кристаллических форм (триклинную, кубическую и др.) с различными свойствами: плотностью от 2,0 до 2,4
г/см
3
, t
плот 585 до 610 °С при давлении в несколько десятков атмосфер, температурой возгонки от 416 до 423 °С, удельным электросопротивлением от 10
9до 10
14
омЧ
см.Красный Ф. на воздухе не самовоспламеняется; вплоть до температуры 240–250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и др., растворим в трибромиде Ф. При температуре возгонки красный Ф. превращается в пар, при охлаждении которого образуется в основном белый Ф.
); плотность 1,828
г/см
3,
t
пл44,1 °С,
t
кип280,5 °C, теплота плавления 2,5
кдж/мольP
4(0,6
ккал/мольP
4), теплота испарения 58,6
кдж/мольР
4(14,0
ккал/мольP
4)
,давление пара при 25 °С 5,7
н/м
2(0,043
мм рт. ст.)
.Коэффициент линейного расширения в интервале температур от 0 до 44 °С равен 12,4Ч10
-4
,теплопроводность 0,56
вт/(
мЧК) [1,1346Ч10
-3
кал/(
смЧ
секЧ°С)] при 25 °С. По электрическим свойствам «белый Ф. близок к диэлектрикам: ширина запрещенной зоны около 2,1
эв,удельное электросопротивление 1,54Ч10
11
омЧ
см,диамагнитен, удельная магнитная восприимчивость – 0,86Ч10
-6. Твёрдость по Бринеллю 6
Мн/м
2(0,6
кгс/мм
2)
.a-форма белого Ф. хорошо растворяется в сероуглероде, хуже – в жидком аммиаке, бензоле, четырёххлористом углероде и др. При – 76,9 °С и давлении 0,1
Мн/м
2(1
кгс/см
2) a-форма переходит в низкотемпературную b-форму (плотность 1,88
г/см
3)
.С повышением давления до 1200
Мн/м
2(12 тыс.
кгс/см
2) переход происходит при 64,5 °С. b-форма – кристаллы с двойным лучепреломлением, их структура окончательно не установлена. Белый Ф. ядовит: на воздухе при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой (растворимость в воде при 25 °С 3,3Ч10
-4%)
.Нагреванием белого Ф. без доступа воздуха при 250–300 °С в течение нескольких часов получают красный Ф. Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а также примесями (иод, натрий, селен). Обычный товарный красный Ф. практически полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При длительном нагревании, необратимо может переходить в одну из кристаллических форм (триклинную, кубическую и др.) с различными свойствами: плотностью от 2,0 до 2,4
г/см
3
, t
плот 585 до 610 °С при давлении в несколько десятков атмосфер, температурой возгонки от 416 до 423 °С, удельным электросопротивлением от 10
9до 10
14
омЧ
см.Красный Ф. на воздухе не самовоспламеняется; вплоть до температуры 240–250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и др., растворим в трибромиде Ф. При температуре возгонки красный Ф. превращается в пар, при охлаждении которого образуется в основном белый Ф. ,
b= 4,38
,
b= 4,38
 ,
с=
10,50
,
с=
10,50
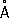 ), решётка построена из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов, плотность 2,69
г/см
3, t
плоколо 1000 °С под давлением 1,8Ч10
3
Мн/м
2(18Ч10
3
кгс/см
2)
.По внешнему виду чёрный Ф. похож на графит; полупроводник: ширина запрещенной зоны 0,33
эвпри 25 °С; имеет удельное электросопротивление 1,5
омЧ
см,температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27Ч10
-6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
), решётка построена из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов, плотность 2,69
г/см
3, t
плоколо 1000 °С под давлением 1,8Ч10
3
Мн/м
2(18Ч10
3
кгс/см
2)
.По внешнему виду чёрный Ф. похож на графит; полупроводник: ширина запрещенной зоны 0,33
эвпри 25 °С; имеет удельное электросопротивление 1,5
омЧ
см,температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27Ч10
-6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.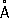 , ионные радиусы: P
5 +0,35
, ионные радиусы: P
5 +0,35
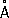 , P
3 +0,44
, P
3 +0,44
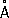 , P
3-1,86
, P
3-1,86
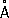 .
.