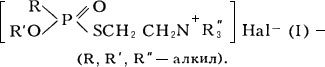Страница:
В промышленных масштабах P
4O
10получают сжиганием элементарного фосфора в избытке сухого воздуха с последующей конденсацией твёрдого продукта из паров. Очищают P
4O
10от примесей (фосфорных кислот), возгонкой. Фосфорный ангидрид в виде паров или дыма сушит слизистые оболочки, вызывает кашель, удушье, отёк лёгких, ожоги на коже, поэтому при работе с ним следует соблюдать правила техники безопасности.
Применяют фосфорный ангидрид для удаления воды из газов и жидкостей (не реагирующих с P 4O 10) ,в органических и неорганических синтезах как конденсирующий агент, иногда как компонент фосфатных стекол и катализатор.
Фосфористый ангидрид P 4O 6(P 2O 3), бесцветное хлопьевидное вещество, кристаллическая структура моноклинная, плотность 2,135 г/см 2, t пл23,8 °С, t кип175,4 °С, растворяется в сероуглероде и бензоле. При растворении P 4O 6в холодной воде образуется фосфористая кислота H 3PO 3, а в горячей воде – элементарный фосфор, фосфин, фосфорная кислота и др. соединения. При нагревании выше 210 °С трёхокись фосфора разлагается на PO 2и красный фосфор. Легко окисляется воздухом до пятиокиси. Получают трёхокись окислением фосфора при ограниченном доступе воздуха. Трёхокись фосфора широко используется в органических синтезах.
Четырёхокись фосфора (PO 2) n , белый хлопьевидный порошок, после возгонки которого образуются блестящие кристаллы; плотность 2,54 г/см 3при 22,6 °С; имеются данные о полимерном строении четырёхокиси. Хорошо растворима в воде, образует с ней в основном H 3PO 3и конденсированные полифосфорные кислоты, а также небольшое количество PH 3. Может быть получена, подобно трёхокиси, сжиганием фосфора при низкой температуре с ограниченным количеством воздуха или нагреванием P 4O 6в запаянной трубке при 250 °С с последующей очисткой.
Лит.см. при ст. Фосфор.
Л. В. Кубасова.
люминесценция,продолжающаяся значительное время после прекращения возбуждения (в отличие от
флуоресценции
)
.Разделение люминесценции по длительности послесвечения на Ф. и флуоресценцию весьма условно, по существу устарело, т.к. не отражает механизма процесса преобразования энергии. Ф. продолжается иногда несколько часов и даже суток, а иногда – несколько микросекунд.
Применяют фосфорный ангидрид для удаления воды из газов и жидкостей (не реагирующих с P 4O 10) ,в органических и неорганических синтезах как конденсирующий агент, иногда как компонент фосфатных стекол и катализатор.
Фосфористый ангидрид P 4O 6(P 2O 3), бесцветное хлопьевидное вещество, кристаллическая структура моноклинная, плотность 2,135 г/см 2, t пл23,8 °С, t кип175,4 °С, растворяется в сероуглероде и бензоле. При растворении P 4O 6в холодной воде образуется фосфористая кислота H 3PO 3, а в горячей воде – элементарный фосфор, фосфин, фосфорная кислота и др. соединения. При нагревании выше 210 °С трёхокись фосфора разлагается на PO 2и красный фосфор. Легко окисляется воздухом до пятиокиси. Получают трёхокись окислением фосфора при ограниченном доступе воздуха. Трёхокись фосфора широко используется в органических синтезах.
Четырёхокись фосфора (PO 2) n , белый хлопьевидный порошок, после возгонки которого образуются блестящие кристаллы; плотность 2,54 г/см 3при 22,6 °С; имеются данные о полимерном строении четырёхокиси. Хорошо растворима в воде, образует с ней в основном H 3PO 3и конденсированные полифосфорные кислоты, а также небольшое количество PH 3. Может быть получена, подобно трёхокиси, сжиганием фосфора при низкой температуре с ограниченным количеством воздуха или нагреванием P 4O 6в запаянной трубке при 250 °С с последующей очисткой.
Лит.см. при ст. Фосфор.
Л. В. Кубасова.

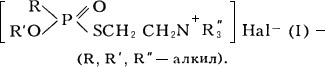
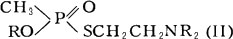 ,
, (III).
(III).