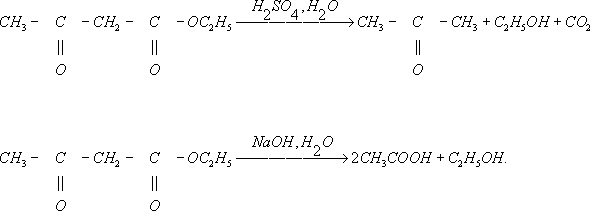
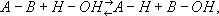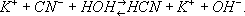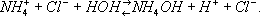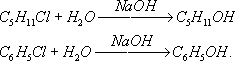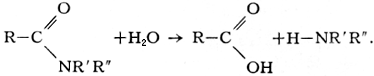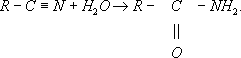угольной кислоты
H
2CO
3, например NaHCO
3(
гидрокарбонат натрия
). Г. получают действием CO
2на карбонаты или гидроокиси в присутствии воды. При нагревании они превращаются в средние соли —
карбонаты
, например 2NaHCO
3= Na
2Co
3+ H
2O + CO
2. В противоположность большинству карбонатов все Г. в воде растворимы. Г. кальция Са (НСО
3)
2обусловливает временную
жёсткость воды
. В организме Г. выполняют важную физиологическую роль, являясь буферными веществами, регулирующими постоянство реакции крови (см.
Буферные системы
).
кодеина
, с которым Г. сходен по действию, но более активен. Применяют в таблетках при различных заболеваниях лёгких и верхних дыхательных путей.
Водолазное дело
.