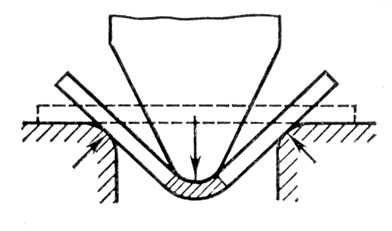
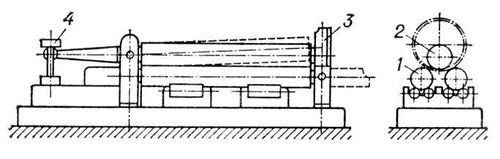
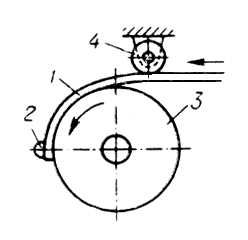
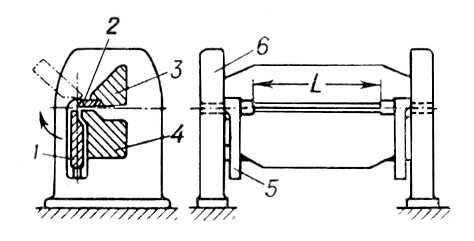
Страница:
потенциалом термодинамическим
. В изотермическом равновесном процессе, происходящем при постоянном давлении, убыль Г. э. данной системы равна полной работе, производимой системой в этом процессе, за вычетом работы против внешнего давления (т. е. равна максимальной полезной работе). Г. э. выражается обычно в
кдж/мольили в
ккал/моль. С помощью Г. э. и её производных могут быть в простой форме выражены др. термодинамические функции и свойства системы (
внутренняя энергия
,
энтальпия
,
химический потенциал
и др.) в условиях постоянства температуры и давления. При этих условиях любой термодинамический процесс может протекать без затраты работы извне только в том направлении, которое отвечает уменьшению
G(
dG
< 0). Пределом протекания его без затраты работы, т. е. условием равновесия, служит достижение минимального значения
G(
dG = 0, d
2G > 0). Г. э. широко используется при рассмотрении различных термодинамических процессов, проводимых при постоянных температуре и давлении. Через Г. э. определяется работа обратимого намагничивания магнетика и поляризации диэлектрика в этих условиях. Знание Г. э. важно для термодинамического рассмотрения фазовых переходов. Константа равновесия
К
ахимической реакции при любой температуре
Топределяется через стандартное изменение Г. э.
DG°соотношением
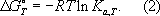
Широко используется Г. э.
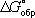 образования химического соединения, равная изменению Г. э. в реакции образования данного соединения (или простого вещества) из
стандартного состояния
соответствующих простых веществ. Для любой химической реакции
образования химического соединения, равная изменению Г. э. в реакции образования данного соединения (или простого вещества) из
стандартного состояния
соответствующих простых веществ. Для любой химической реакции
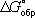 равна алгебраической сумме произведений
равна алгебраической сумме произведений
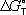 веществ, участвующих в реакции, на их коэффициенты в уравнении реакции. Для 298,15
К
веществ, участвующих в реакции, на их коэффициенты в уравнении реакции. Для 298,15
К
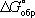 известны уже для нескольких тысяч веществ, что даёт возможность расчётным путём определять соответствующие значения
известны уже для нескольких тысяч веществ, что даёт возможность расчётным путём определять соответствующие значения
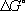 и
К
адля большого числа реакций.
и
К
адля большого числа реакций.
Наряду с уравнением (1) Г. э. может быть определена также через внутреннюю энергию
U,
гельмгольцеву энергиюАи произведение объёма
Vна давление
рна основе равенств
G = U — TS + pV, (3)
G = A + pV, (4)
Характеристическую функцию Г. э. разные авторы долгое время называли по-разному: свободной энергией, свободной энергией при постоянном давлении, термодинамическим потенциалом, термодинамическим потенциалом Гиббса, изобарно-изотермическим потенциалом, свободной энтальпией и др.; для обозначения этой функции использовались различные символы (
Z, F, Ф). Принятые здесь термин «Г. э.» и символ
Gотвечают решению 18-го конгресса Международного союза чистой и прикладной химии 1961.
В. А. Киреев.
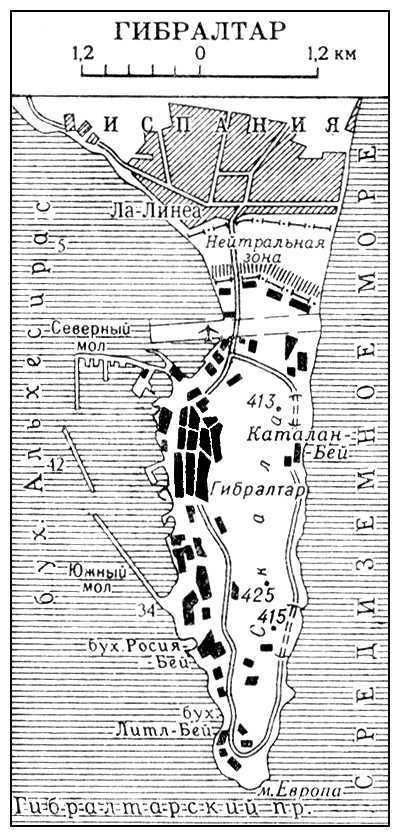
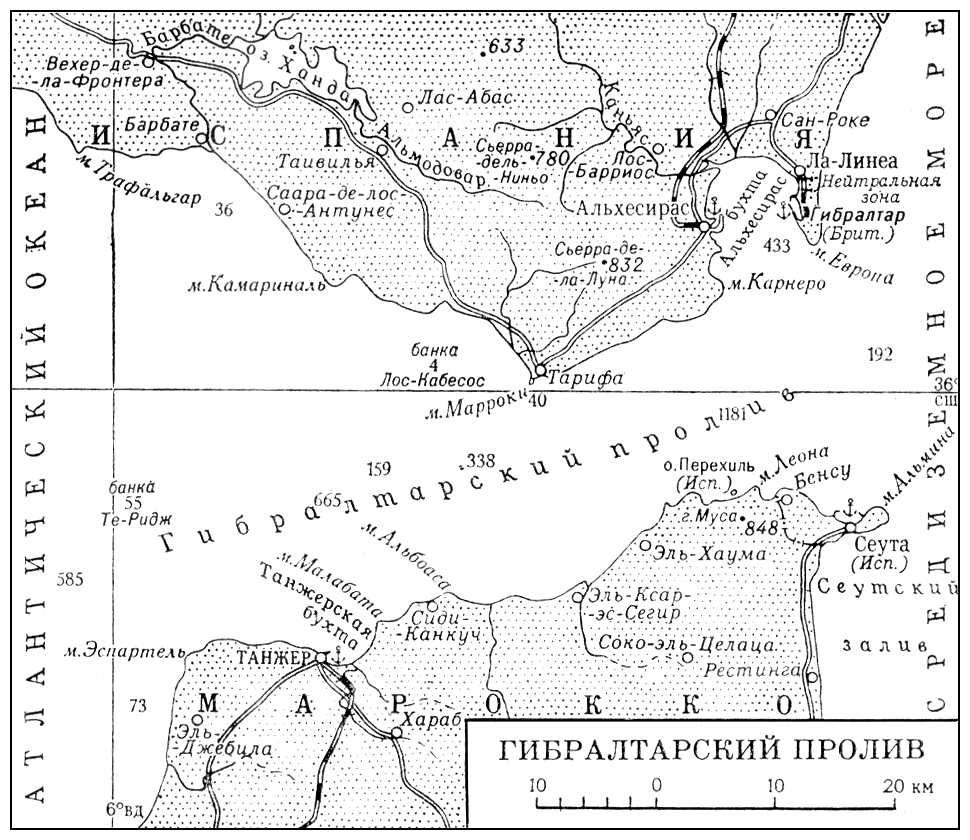
Гвельфы и гибеллины
.
Донателло
и Ф.
Брунеллески
. В 1425—52, в период работы Г. над восточными, или третьими, дверями флорентинского баптистерия, в его творчестве происходит поворот к принципам искусства Возрождения. В этом главном произведении Г. выделяются десять рельефов с изображением библейских сцен на фоне архитектуры и пейзажа, отмеченных поэтичностью и жизненностью образов, пластическим богатством в изображении окружающей среды и человеческих фигур. Использование опыта античного искусства и открытий современников в области линейной перспективы, виртуозное владение материалом в создании тончайших градаций рельефа от очень высокого к очень низкому придают композициям Г. пространственную глубину, ритмическое многообразие и музыкальную плавность линий. Г. принадлежат также рельефы на купели баптистерия в Сиене (бронза, 1417—27). Ювелирные работы Г. не сохранились.
Соч.: Commentarii, 1447—1455 (рукопись); Lorenzo Ghiberti's Denkwurdigkeiten (I Commentarii)..., hrsg. von J. von Schlosser, Bd 1—2, В., 1912 (неполный рус. пер. — Commentarii. Записки об итальянском искусстве, прим. и вступит, ст. А. Губера, М., 1938).
Лит.:Krautheimer R. and Krautheimer-Hess Т., Lorenzo Ghiberti, Princeton (New Jersey), 1956.
 Л. Гиберти. Восточные (т. н. Райские) двери баптистерия во Флоренции. Бронза. 1425—52.
Л. Гиберти. Восточные (т. н. Райские) двери баптистерия во Флоренции. Бронза. 1425—52.